Электронное строение кальция

В атомах химических элементов есть свои уровни комфортности? RU EN. Обозначение — Ca. Столбцы этой таблицы называются группами элементов.
Основные реакции кальция с элементами и соединения приведены в таблице. Большинство солей кальция фторид, сульфат, карбонад кальция не растворяются в воде.
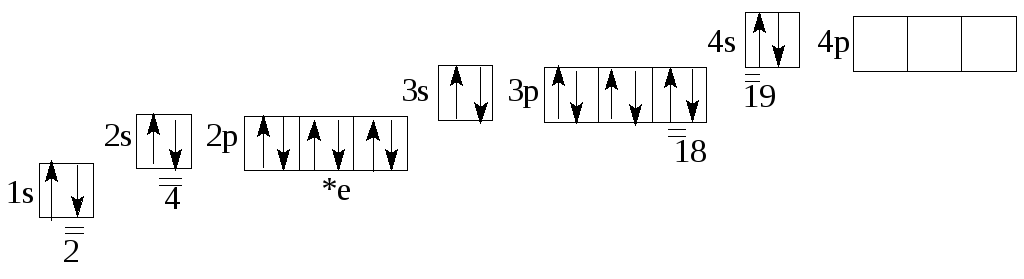
Элемент в составе соединений используется в строительстве, пищевой и химической промышленности, медицине. Кальций — активный щелочноземельный металл, являющийся восстановителем. На внешнем энергетическом уровне атома находится два электрона, определяющие валентность.
Кальций входит в состав минералов, быстро окисляется на воздухе, реагирует с неметаллами при нагревании, водой и кислотами.
Оксид кальция называется негашёной известью, гидроксид — гашёной известью. Большинство солей кальция плохо растворяются в воде.
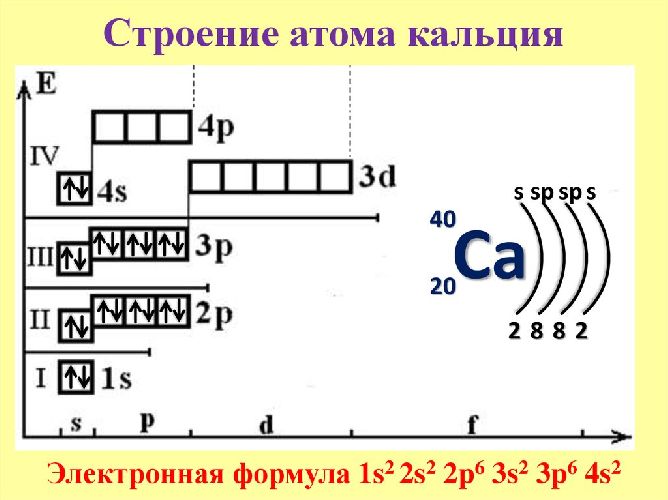
Кальций входит в состав костей, крови, участвует в метаболизме, применяется в промышленности, строительстве и медицине. Строение атома кальция.
Средняя оценка: 4. Кальций не может переходить в возбуждённое состояние. Что мы узнали? Начать тест. Доска почёта.

Оценка доклада 4. Поставить оценку. Основной терм - 1 S 0 конфигурации 4s 2.
При возбуждении s-электрона возникают синглетные и триплетные термы электронных конфигураций 4snl, переходы внутри которых формируют спектр атома. Уровень 4p 3 P - метастабильный. Впервые оптический спектр Ca I исследовали Paschen F. Характерным для спектра атома является наличие двух систем серий: две главные 5 1 S - n 1 P и 5 3 S - n 3 P; две резкие или вторые побочные ; 4 1 P - n 1 S и 4 3 P - n 3 S; две диффузные или первые побочные 4 1 P - n 1 D и 4 3 P - n 3 D ; две фундаментальные или Бергмана 3 1 D - n 1 F и 3 3 D - n 3 F.
Исключение из правил - сильная интеркомбинационная линия 4s 2 1 S 0 - 4p 3 P. При одновременном возбуждении двух s -электронов выше границы ионизации появляются смещенные термы конфигураций 3d 2 D nl и 4p 2 P nl, переходы между которыми усложняют изучение спектра атома.